Ça y et, la COP26 s'achève. Les pollueurs sont contents, ils vont pouvoir continuer. Les climato-anxieux n'ont plus qu'à se tourner vers le prozac ou la radicalisation. Et les autres sont divisés en deux: ceux qui sentent bien que quelque chose se détraque et qui espèrent une solution (quelque part, quelqu'un...mais pas eux) et les ignorants qui se complaisent dans leur état, mais qui seront les premiers à prendre les armes quand les gouvernements n'auront plus d'autres choix que d'imposer des changements à leur mode de vie.
En fait, la COP26 a quand même eu quelque chose de bon. Elle m'a permis de prendre connaissance de ce bel article publié par The Globe and Mail: What lies beneath: Exploring Canada’s invisible carbon storehouse. L'article impressionnant par son iconographie montre que les écosystèmes forestiers du Canada ne seraient pas les plus performants à long terme pour capturer et stocker le carbone atmosphérique et que, plutôt que de planter des arbres pour compenser nos émissions de carbone, on ferait mieux d'y penser à deux fois avant de perturber des écosystèmes moins boisés comme les tourbières, mais plus efficaces. L'article met l'accent sur le stockage naturel du carbone, mais ne nous apprend pas grand chose sur cet atome - ses origines, sa vie, son oeuvre - et sur les relations qu'il y a entre le carbone, le CO2, la biomasse et nous.
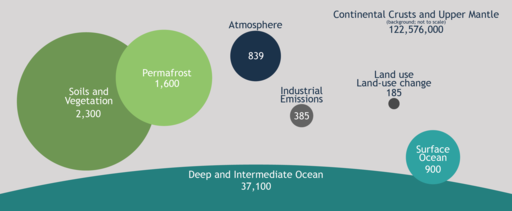
Et puis, j'avais aussi envie de savoir comment le carbone se répartissait sur Terre. Si bien que pour démêler tout ça, il a fallu que je me replonge dans le cycle du carbone. Pour commencer, l'atome C peut être inorganique ou organique selon les liaisons qu'il établit avec d'autres atomes.
"Inorganique" pourrait se définir comme un carbone qui existerait même si la vie n'existait pas. C'est le cas du dioxyde de carbone CO2 un des gaz responsables de l'effet de serre, de l'acide carbonique H2CO3 responsable de l'acidification des océans, du carbonate de calcium (CaCO3) qui compose 50-90 % du calcaire et du diamant (C) qui est un cristal pur d'atomes de carbone.
En faisant mes recherches, j'ai lu la définition suivante: "le carbone inorganique est celui qui est associé à des composés inorganiques, c'est-à-dire des composés qui ne sont pas et n'ont pas été du vivant et qui ne contiennent pas de liens C-C ou C-H (hydrogène)". Pourtant le diamant (exclusivement des liaisons C-C) est inorganique.
Et le charbon ? De l'anthracite à la lignite en passant par la houille selon le degré de carbonisation, il est un cas un peu particulier. Bien que le géologue n'hésite pas à dire qu'il est minéral, le carbone qui le constitue est quand même d'origine végétale. Il est le produit de 300 à 500 millions d'années de fossilisation des forêts préhistoriques du carbonifère. Il en est de même pour le pétrole et tous les hydrocarbures qui le composent, d'où le qualificatif "fossiles" utilisé pour ces sources d'énergie.
Ce qui nous amène au carbone organique qui se définit comme le carbone constituant le vivant ou produit par lui. Quand on dit "constituant", cela signifie qu'il est à la base de toutes les molécules du vivant: les glucides, les lipides, les protéines, l'ADN, etc, etc.. Pensez à n'importe quoi: un ongle, un oeil, un nerf, l'écorce d'un arbre et même l'arbre, la carapace d'un coléoptère, le lait, le pain, tout ce qui est vivant ou l'a été est fait de molécules à base de carbone.
Le carbone n'est pas figé. Il peut passer naturellement de l'état organique à l'état inorganique. C'est même plutôt "facile" et il peut le faire de trois façons:
- La respiration. La plupart des êtres vivants inspirent de l'oxygène et rejetent du CO2 (carbone inorganique). Ce dioxyde de carbone vient du métabolisme des glucides (carbone organique), (CH2O)n, qui produit de l'énergie selon la réaction simplifiée :
(CH2O)n + O2 -> énergie + H2O + CO2
Le n de la formule signifie que l'on peut répéter le motif entre parenthèses autant de fois que l'on veut ou presque. Ainsi, la formule du glusose est (CH2O)6 ou C6H12O6.
- La fermentation qui est un autre moyen de produire de l'énergie à partir des glucides, mais sans oxygène. Elle est réalisée essentiellement par des bactéries selon l'équation:
(CH2O)n -> énergie + CO2 + CH4.
La fermentation produit deux gaz: le dioxyde de carbone (inorganique) et le méthane (organique) qui est le plus petit des hydrocarbures. La durée de vie de ce dernier est assez courte (moins d'une dizaine d'années dans l'atmosphère) car au contact de l'air il se transforme en dioxyde de carbone (ce qui n'arrange pas nos affaires) selon la réaction :
CH4 + 2 O2 -> CO2 + 2 H2O
- La combustion des matières carbonées (en incluant le charbon et les hydrocarbures) qui produit du dioxyde de carbone CO2 selon l'équation:
Carbone inorganique ou organique + O2 + Énergie -> Énergie + Lumière + Cendres + H2O + CO2
En passant, l'essence "écologique" à base de biothéanol produit aussi du CO2 en brûlant : CH3CH2OH + 3 O2 → 2 CO2 + 3 H2O
On constate rapidement que le bilan de toutes ces réactions se solde inévitablement par la production de dioxyde de carbone et de méthane, deux gaz à effet de serre. Il est à noter que l'effet de serre du méthane est 20 fois supérieur à celui du dioxyde de carbone et qu'il en existe d'énormes réserves piégées sous terre; c'est le gaz naturel extrait pour être brûlé.
Heureusement, l'inverse se produit également et le carbone inorganique peut se transformer en carbone organique. Les voies de transformation sont par contre moins nombreuses. En fait, il n'y en a qu'une et c'est la photosynthèse réalisée par les végétaux chlorophylliens et les cyanobactéries qui transforment le CO2 en glucides selon la réaction :
CO2 + H2O + Lumière -> (CH2O)n + O2
Tout le reste du carbone organique vient de la transformation de ces premières molécules (Merci aux plantes et aux bactéries !)
Enfin, pour être complet sur le cycle du carbone, il faut parler du rôle important de réservoir de carbone que jouent les océans. C'est un rôle complexe qui se base sur deux équilibres dynamiques. Avant toute chose, il faut savoir qu'une certaine quantité de CO2 se dissout spontanément dans l'eau, jusqu'à ce qu'elle en soit saturée (c'est un peu comme le sel : il arrive un noment où on ne peut plus le dissoudre). L'avantage du CO2 est qu'il se combine à l'eau pour donner de l'acide carbonique. C'est le premier équilibre qui peut s'écrire:
CO2 + H2O <-> H2CO3
Par conséquent, plus il y a de CO2 dans l'atmosphère, plus il y a d'acide carbonique dans l'eau et plus les eaux deviennnent acides. La réaction est réversible (d'où les doubles flèches) et dépend des conditions du milieu. En réalité, l'équilibre est plus complexe que cela et s'écrit:
CO2 + H2O <> H2CO3 <-> HCO3- (bicarbonate) + H+ <-> CO32- (carbonate) + H+
Les formes ioniques (carbonates) de l'acide carbonique sont importantes (95 % du carbone dissout est sous la forme de bicarbonate), car elles sont impliquées dans le deuxième équilibre qui contribue à la régulation du CO2. En effet, ces carbonates peuvent rencontrer un ion calcium (Ca2+) et se combiner avec pour former spontanément, ou avec l'aide d'un animal qui fabrique sa coquille, du carbonate de calcium insoluble qui va précipiter au fond de l'océan et former les futures roches calcaires:
2 HCO3- + Ca2+ <-> Ca(HCO3)2 [soluble] <-> CaCO3 [insoluble] + H2CO3
Tous ces équilibres fluctuent en fonction des conditions du milieu: pression, température, sans oublier la vie sous-marine qui respire et fait de la photosynthèse.
Voilà, en résumé, la vie du carbone ! Elle est simplifiée et incomplète, mais elle donne quand même une bonne idée de la complexité des équilibres qui ont mis des millions d'années à s'établir et dans lesquels nous venons jouer avec insouciance.